Hay una explosión de investigación básica relacionando microorganismos intestinales con condiciones y enfermedades muy variadas. Los desórdenes neurológicos, que muchas veces se consideran de origen genético e incurables, tienen un flanco abierto. Es posible empezar a soñar con mejorar la vida de personas autistas e incluso podríamos pensar en curar enfermedades como el mal de Parkinson, Alzheimer o la Esclerosis Múltiple
En la entrada anterior hicimos una pequeña introducción de la interacción microorganismos intestinales (MOIs) con el cerebro, como inciden los primeros sobre el segundo y cerramos con algunos experimentos hechos con ratones libres de microorganismos, descubriéndose relaciones más que interesantes entre la ausencia de estos organismos y algunas condiciones, conductas o patologías que se desarrollaban.
La idea en esta entrada es profundizar en ese tema y ver como anda la situación con los humanos, que en última instancia, es el objetivo de muchas de estas investigaciones. Si algo queda claro es que los MOIs tienen una profunda relación con el cerebro. De hecho, hay evidencia que permite pensar que son fundamentales para la evolución de este órgano a lo largo de la vida humana. Por ejemplo, se encontró que la diversidad microbiana se correlaciona en adultos mayores con índices globales de salud, fragilidad y función inmune (1). Aunque siendo justos, lo que se correlacionó positivamente fue una dieta variada con los MOIs, ya que las personas que comían alimentos procesados y suaves (a menudo en hogares de ancianos) tenían una diversidad reducida en su microbiota; mientras que las personas con dieta rica en frutas y verduras tenían más diversidad de MOIs. Se podría decir que la diversidad en la microbiota es una característica potencial del envejecimiento saludable.
La evidencia puede parecer demasiado indirecta. Pero no hay que perder de vista que esto va en concordancia con estudios hechos en ratones, que mostraron déficit conductuales relacionados con la edad coincidentes con cambios en la microbiota y que la neuroinflamación asociada con la edad puede mejorarse mediante una intervención dietética dirigida a la microbiota. Esto último es importante, ya que se ha demostrado que la microbiota regula la activación de la microglia, clave en el envejecimiento y neurodegeneración (2).
Microbiota y desórdenes neurológicos
Si la microbiota la podemos asociar, aunque sea preliminarmente, con una buena vejez y un buen desarrollo neurológico... ¿Podemos asociarla con malos funcionamientos, es decir, enfermedades o condiciones mentales de distinta índole? Y si la respuesta es afirmativa, ¿cómo se relacionan? Spolier que de seguro toma atodos nadie por sorpresa: efectivamente hay algunas asociaciones interesantes. La siguiente figura nos muestra un resumen de algunas de las principales afecciones mentales que se han relacionado con los cambios en los MOIs.
En pocas palabras, la microbiota la tenemos relacionada con diversos procesos: la maduración de la microglia (nuestros soldados en el sistema nervioso central), la formación correcta de la barrera hematoencefálica (que da una protección mecánica al cerebro), la neuroinflamación, la resistencia a placas proteicas, entre otras cosas. ¿Y cómo traducimos todo esto a algo práctico? En orden de mayor a menor evidencia y respaldo disponible, podemos decir que los MOIs tienen relación con:
1) Esclerosis múltiple (EM); descrita como una enfermedad neurológica crónica, inflamatoria y autoinmune. que genera una desmielinización de las neuronas. Recordemos que mielina es una estructura que envuelve parcialmente a los axones y facilita la transmisión del impulso nervioso (fig. 2) La relación con los MOIs salta a la vista y no sorprende que hayan tantos estudios que encuentren este vínculo. Por ejemplo, se ha encontrado en niños con EM que hay cambios discretos, aunque sutiles, en la diversidad de la microbiota si los comparamos con personas sanas menores de 18 años (3); también hay estudios de trasplante de microbiota, encontrándose importantes efectos inmunológicos (4,5). Incluso en estudios preliminares con ratones libres de microorganismos se encontró una gran resistencia al desarrollo de encefalomielitis autoinmune inducida (un modelo de estudio que ha mostrado ser útil para la EM), condición que se revierte cuando se hacen trasplantes fecales (6, 7).
La evidencia puede parecer demasiado indirecta. Pero no hay que perder de vista que esto va en concordancia con estudios hechos en ratones, que mostraron déficit conductuales relacionados con la edad coincidentes con cambios en la microbiota y que la neuroinflamación asociada con la edad puede mejorarse mediante una intervención dietética dirigida a la microbiota. Esto último es importante, ya que se ha demostrado que la microbiota regula la activación de la microglia, clave en el envejecimiento y neurodegeneración (2).
Microbiota y desórdenes neurológicos
Si la microbiota la podemos asociar, aunque sea preliminarmente, con una buena vejez y un buen desarrollo neurológico... ¿Podemos asociarla con malos funcionamientos, es decir, enfermedades o condiciones mentales de distinta índole? Y si la respuesta es afirmativa, ¿cómo se relacionan? Spolier que de seguro toma a
 |
| Fig. 1: La ausencia de microbiota en ratones produce muchos cambios neurobiológicos que son relevantes en diversos trastornos neurológicos, incluidas alteraciones en la ansiedad, volumen hipocampal reducido y mielinización reducida. En español: los ratones se ponen más ansiosos, tienen problemas de memoria y pueden presentar síntomas asociados a la esclerosis múltiple. En la imagen se puede ver un resumen de los principales hallazgos y su vínculo con distintos trastornos mentales. Los ratones libres de gérmenes han demostrado la participación de la microbiota con señalización cerebral en la sociabilidad, el dolor visceral, la sensibilidad al estrés, las respuestas de miedo y ansiedad y la función inmune. Imagen obtenida de acá |
En pocas palabras, la microbiota la tenemos relacionada con diversos procesos: la maduración de la microglia (nuestros soldados en el sistema nervioso central), la formación correcta de la barrera hematoencefálica (que da una protección mecánica al cerebro), la neuroinflamación, la resistencia a placas proteicas, entre otras cosas. ¿Y cómo traducimos todo esto a algo práctico? En orden de mayor a menor evidencia y respaldo disponible, podemos decir que los MOIs tienen relación con:
1) Esclerosis múltiple (EM); descrita como una enfermedad neurológica crónica, inflamatoria y autoinmune. que genera una desmielinización de las neuronas. Recordemos que mielina es una estructura que envuelve parcialmente a los axones y facilita la transmisión del impulso nervioso (fig. 2) La relación con los MOIs salta a la vista y no sorprende que hayan tantos estudios que encuentren este vínculo. Por ejemplo, se ha encontrado en niños con EM que hay cambios discretos, aunque sutiles, en la diversidad de la microbiota si los comparamos con personas sanas menores de 18 años (3); también hay estudios de trasplante de microbiota, encontrándose importantes efectos inmunológicos (4,5). Incluso en estudios preliminares con ratones libres de microorganismos se encontró una gran resistencia al desarrollo de encefalomielitis autoinmune inducida (un modelo de estudio que ha mostrado ser útil para la EM), condición que se revierte cuando se hacen trasplantes fecales (6, 7).
 |
| Fig. 2. Las partes de una neurona. Las dendritas captan impulsos de otras neuronas, que se transmiten por el cuerpo neuronal y viaja por el axón (la "cola") dando "saltos", ya que el impulso viaja a través de los espacios que deja disponible la vaina de mielina (en azul), hasta que llega al otro extremo, lugar donde el impulso puede distribuirse a más neuronas. |
Si consideramos los estudios en modelos animales y humanos, los MOIs estarían muy relacionados con la EM. La pregunta clave es si esto podemos aprovecharlo para prevenir y minimizar los síntomas en los pacientes. Estudios muy preliminares invitan al optimismo, ya que la administración de ciertos probioticos (entre ellos, bacterias del género Lactobacillus) revertían los cambios en la microbiota y mostraron propiedades antiinflamatorias (8).
2) Trastorno del espectro autista (TEA); condición ligada a problemas en la comunicación e interacción social, además de presentar patrones repetitivos de comportamiento, intereses o actividades. Se sabe que el conjunto de síntomas tiene un fuerte componente genético, pero los factores ambientales influyen mucho. Un rasgo que muchas veces es obviado, pero que levanta sospechas para nuestro tema, es que las personas autistas suelen presentar problemas gastrointestinales. Igual que con la esclerosis, se ha identificado que la composición de los MOIs es distinta respecto a personas no autistas (9, 10). Los estudios en modelos animales son más que interesantes: los ratones libres de microorganismos tienen problemas sociales y conductas repetitivas (11) y basta el traspaso de microbiota de una persona autista a un ratón normal para que éste desarrolle síntomas característicos (12).
La administración de una sola cepa bacteriana, como nuestra ya conocida Lactobacillus (parece que le debemos mucho a esta bacteria. Ya saben, a comer yogurt por si acaso), podría revertir muchos de los cambios conductuales y gastrointestinales reportados tanto en estudios en humanos como en modelos animales del TEA (13). Uno puede ser optimista con los estudios realizados hasta ahora, que ya incluyen algunos ensayos clínicos básicos en humanos, pero sin duda queda mucho por avanzar antes de poder transformar todo esto en una intervención efectiva para mejorar la vida de las personas con TEA.
3) Enfermedad de Parkinson (EP); enfermedad neurodegenerativa crónica que disminuye el movimiento, aumenta la rigidez muscular y se caracteriza por un temblor en las manos. Hay una proteína clave, la Alfa-Sinucleína, que en su forma normal, regula la comunicación entre neuronas, pero que con la enfermedad tiende a acumularse en el cerebro (fig. 3).
 |
| Fig. 3. La Alfa sincucleína por sí sola es útil, pero en la EP se juntan formando fibras que se acumulan en el cerebro, formando los "Cuerpos de Levy" y provocando así la enfermedad. Estas fibras tienen la capacidad de transformar a otras proteínas en fibras igualmente infecciosas. Imagen obtenida de acá |
Lo interesante es que esta proteína también la encontramos en la mucosa de nervios, fibras y ganglios, e incluso se ha sugerido que puede viajar del intestino al cerebro a través del nervio vago (14). ¿Intestino y salud mental? Pues sí, una vez más podrían estar relacionados. Si uno se pone creativo, podría pensar que si la proteína va del intestino al cerebro por el nervio vago, cortando este, se acaba el problema. Por tosco que suene, pareciera que la vagotomía efectivamente protege contra la EP (15). Al igual que en los casos anteriores, las personas enfermas tienen una composición de microbiota distinta respecto a las sanas, aunque no hay un culpable identificado aún. El trasplante de MOIs en personas con EP a ratones libres de microorganismos hacen que estos generen neuroinflamación y problemas de motricidad; síntomas que mejoran cuando se dan antibióticos (16).
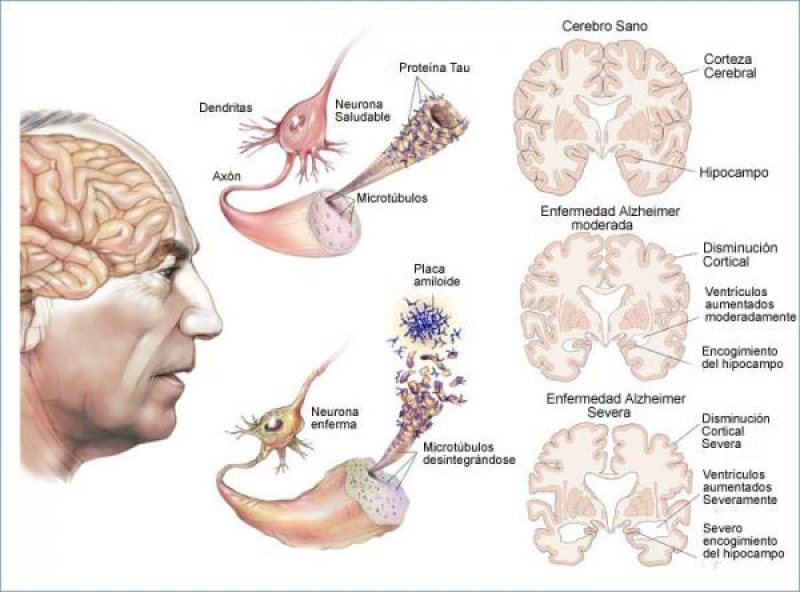
4) Enfermedad de Alzheimer, neurodegenerativa, cuyo rasgo distintivo es la pérdida de memoria, aunque también va asociada a cambios de personalidad, dificultad para caminar y comunicarse, entre otras (Fig. 4). La idea de una relación entre la enfermedad y las bacterias no es nueva, pero ha sido difícil encontrar vínculos causales, entre otras cosas porque demostrar que es una infección en el cerebro implica grandes retos logísticos y éticos.
Aunque la cantidad de información manejada es menor que en los casos anteriores, no se pasa por alto que las proteínas amiloides, características de la EA cuando se acumulan en el cerebro, tienen un rol antimicrobiano (17). Más allá de esto, lo que se tiene claro es que pacientes con EA tienen una composición mayor en sus fecas de bacterias asociadas a la inflamación (Escherichia y Shigella) (18), lo que sugiere que cambios en la microbiota pueden promover neuroinflamación y esto se ha vinculado a una exacerbación de la EA; mientras que en roedores libres de microorganismos, hay una gran resistencia a la neuroinflamación y a la formación de las placas amiloides (19). Todo esto en conjunto pone en la mira a los MOIs como posibles responsables de la EA.
5) Condiciones varias, entrando en terreno especulativo. Se han realizado algunos vínculos entre los MOI's y situaciones tan disimiles como los ataques cerebrovasculares (a través de la relación entre factores de riesgo como la aterosclerosis y la hipertensión con la riqueza y biodiversidad de la microbiota, 20, 21) y, con mucha menos información, concreta, pero con pistas interesantes, aparecen condiciones como la epilepsia (donde los MOIs parecen tener influencia en zonas clave; 21, 22, 23) e incluso el mal de Huntington, que aunque es una enfermedad genética, se ha encontrado diferencias en metabolitos de bacterias dependiendo si la persona tiene la enfermedad o no (24), además de haber cierta evidencia de pérdida de microbiota saludable en ratones modelo para la investigación de esta enfermedad (25).
Y entonces... ¿Podemos estar en los días finales de todas estas enfermedades y condiciones? Lamentablemente lo máximo a lo que podemos aspirar hoy, con la evidencia existente, es a un mesurado optimismo. Pero eso será tema para la tercera parte de esta saga.
BIBLIOGRAFÍA
(1) Claesson, M. J.; Jeffery, I. B.; Conde S; Power, S. E.; O'Connor, E. M.; Cusack, S.; Harris, H. M.; Coakley, M.; Lakshminarayanan, B.; O'Sullivan, O.; Fitzgerald, G. F.; Deane, J.; O'Connor, M.; Harnedy, N.; O'Connor, K.; O'Mahony, D.; van Sinderen, D.; Wallace, M.; Brenan, L.; Stanton, C.; Marchesi, J. R.; Fitzgerald, A. P.; Shanahan, F.; Hill, C.; Ross, R. P. & O'Toole, P. W. (2012). Gut microbiota composition correlates with diet and health in the elderly. Nature; 488: 178–84.
(2) Erny D.; Hrabe de Angelis, A. L.; Jaitin, D.; Wieghofer, P.; Staszewski, O.; David, E.; Keren-Shaul, H.; Mahlakoiv, T.; Jakobshagen, K.; Buch, T.; Schwierzeck, V.; Utermöhlen, O.; Chun, E.; Garret, W. S.; McCoy, K. D.; Diefenbach, A.; Staeheli, P.; Stecher, B.; Amit & I.; Prinz. M. (2015). .Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci; 18: 965–77.
(3) Tremlett, H.; Fadrosh, D. W.; Farugi, A. A.; Zhu, F.; Hart, J.; Roaslstad, S.; Graves, J.; Lynch, S. & Waubant, E. (2016). Gut microbiota in early pediatric multiple sclerosis: a case-control study. Eur. J. Neurol. 23(8): 1308-1321
(4) Berer, K.; Gerdes, L. A.; Cekanaviciute, E.; Jia, X.; Xiao, L.; Xia, Z.; Liu, C.; Klotz, L.; Stauffer, U.; Baranzini, S. E.; Kümpfel, T.; Hohlfeld, R.; Krishmamoorthy, G. & Wekerle, H. (2017). Gut microbiota from multiple sclerosis patients enables spontaneous autoinmune encephalomyelitis in mice. Proc. Natl Acad Sci USA; 114(40):10719-10724.
(5) Cekanaviciute, E. Yoo, B. B., Runia, T. F., Debelius, J. W.; Singh, S.; Nelson, C. A.; Kanner, R.; Bencosme, Y.; Lee, Y.; Hauser, S. L.; Crabtree-Hartman, E.; Sand, I. K.; Gacias, M.; Zhu, Y.; Casaccia, P.; Cree, B. C. A.; Knight, R.; Mazmanian, S. K. & Baranzini, S. E. (2017). Gut bacteria from multiple sclerosis patients modulate human T cells and exacerbate symptoms in mouse models. Proc. Natl. Acad. Sci. USA. 3; 114(40: 10713-10718.
(6) Berer, K.; Mues, M.; Koutrolos, M.; Rasbi, Z. A.; Boziki, M.; Johner, C.; Wekerle, H. & Krishnamoorthy, G. (2011). Commensal microbiota and myelin autoantigen cooperate to trigger autoinmmune denvelination. Nature; 479: 538-41.
(7) Mazmanian, S. K.; Liu, C. H.; Tzianabos, A. O. & Kasper, D. L. (2005). An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system. Cell; 122: 107–18.
(8) Tankou, S. K.; Regev, K.; Healy, B. C.; Tjon, E.; Laghi, L.; Cox, L. M.; Kivisäkk, P.; Pierre, I. V.; Hrishikesh, L.; Gandhi, R.; Glanz, B.; Stankiewicz, J. & Weiner, H. L. (2018) A probiotic modulates the microbiome and inmunity in multiple sclerosis. Ann. Neurol. 83(6): 1147-1161.
(9) Liu, S.; Li, E.; Sun, Z.; Fu, D.; Duan, G.; Jiang, M.; Yu, Y.; Mei, L.; Yang, P.; Tang, Y. & Zheng, P. (2019). Altered gut microbiota and short chain fatty acids in Chinese children with autism spectrum disorder. Sci rep. 9, 287.
(10) Mayer, E. A.; Padua, D. & Tillisch, K. (2014). Altered brain-gut axis in autism: comorbidity or causative mechanisms? Bioessays; 36: 933-39.
(11) Desbonnet, L.; Clarke, G.; Shanahan, F.; Dinan, T. G. & Cryan, J. F. (2014). Microbiota is essential for social development in the mouse. Mol Psychiatry; 19: 146-48.
(12) Sharon, G.; Cruz, N. J.; Kang, D. W.; Gandal, M. J.; Wang, B.; Kim, Y. M.; Zink, E. M.; Casey, C. P.; Taylor, B. C.; Lane, C. J.; Bramer, L. M.; Isem, N. G.; Hoyt, D. W.; Noecker, C.; Sweredoski, M. J.; Moradian, A.; Borenstein, E.; Jansson, J. K.; Knight, R.; Metz, T. O.; Lois, C.; Geschwind, D. H.; Krajmalnik-Brown, R. & Mazmanian, S. K. (2019). Human gut microbiota from autism spectrum disorder promote behavioral symptoms in mice. Cell; 177: 1600-18.
(13) Sgritta, M.; Dooling, S. W.; Buffington, S. A.; Momin, E. N.; Francis, M. B.; Britton, R. A. & Costa-Mattioli, M. (2019). Mechanisms underliving microbial-mediated changes in social behavior in mouse models of autism spectrum disorder. Neuron, 16; 101(2): 246-259.
(14) Holmqvist, S.; Chutna, O.; Brousset, L.; Aldrin-Kirk, P.; Li, W.; Björklund, T.; Wang, Z. Y.; Rovbon, L.; Melki, R. & Li, J. Y. (2014). Direct evidence of Parkinson pathology spread from the gastrointestinal tract to the brain in rats. Acta Neuropathol.; 128: 805-20.
(15) Svensson, E.; Horvath-Puho, E.; Thomsen, R. W.; Djurhuus, J. C.; Pedersen, L.; Borghammer, P. & Sørensen, H. T. (2015). Vagotomy and subsequent risk of Parkinson's disease. Ann Neurol; 78: 522-29.
(16) Sampson, T. R.; Debelius, J.W.; Thron, T.; Janssen, S.; Shastri, G. G.; Ilhan, Z. E.; Challis, C.; Schretter, C. E.; Rocha, S.; Gradinaru, V.; Chesselet, M. F.; Keshavarzian, A.; Shannon, K. M.; Krajmalnik-Brown, R.; Wittung-Stafshede, P.; Knight, R. & Mazmanian, S. K. (2016). Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson’s disease. Cell; 167: 1469–80.
(17) Soscia, S. J.; Kirby, J. E.; Washicosky, K. J.; Tucker, S. M.; Ingelsson, M.; Hyman, B.; Burton, M. A.; Goldstein, L. E.; Duong, S.; Tanzi, R. E. & Moir, R. D. (2010). The Alzheimer's disease-associated amyloid beta-protein is an antimicrobial peptide. PLoS One; 5: e9505.
(18) Cattaneo, A.; Cattane, N.; Galluzzi, S.; Provasi, S.; Lopizzo, N.; Festari, C.; Ferrari, C.; Guerra, U. P.; Paghera, B.; Muscio, C.; Bianchetti, A.; Volta, G. D.; Turla, M.; Cotelli, M. S.; Gennuso, M.; Prelle, A.; Zanetti, O.; Lussignoli, G.; Mirabile, D.; Bellandi, D.; Gentile, D.; Gentile, S.; Belotti, G.; Villani, D.; Harach, T.; Bolmont, T.; Padovani, A.; Boccardi, A.; Boccardi, M.; Frisoni, G. B. & INDIA-FBP group (2017). Association of brain amyloidosis with pro-inflammatory gut bacterial taxa and peripheral inflammation markers in cognitively impaired elderly. Neurobiol Aging 2017; 49: 60–68.
(19) Harach, T.; Marungruang, N.; Duthilleul, N.; Cheatham, V.; McCoy, K. D.; Frisoni, G.; Neher, J. J.; Fåk, F.; Jucker, M.; Lasser, T. & Bolmont, T. (2017). Reduction of Abeta amyloid pathology in APPPS1 transgenic mice in absence of gut microbiota. Sci Rep; 7: 41802.
(20) Boziatzi, C.; Gloor, G.; Allen-Vercoe, E.; Reid, G.; Wong, R. G.; Uruhart, B. L.; Dinculescu, V.; Ruetz, K. N.; Velenosi, T. J.; Pignanelli, M. & Spence, J. D. (2018). Metabolic products of the intestinal microbiome and extremes of atherosclerosis. Atherosclerosis; 273: 91-97.
(21) Li, J.; Zhao, F.; Wang, Y.; Chen, J.; Tian G.; Wu, S.; Liu, W.; Cui, Q.; Geng, B.; Zhang, W.; Weldon, R.; Auguste, K.; Yang, L.; Liu, X.; Chen, L.; Yang, X.; Zhu, B. & Cai, J. (2017). Gut microbiota dysbiosis contributes to the development of hypertension. Microbiome; 5: 14.
(22) Luczynski, P.; Whelan, S. O.; O'Sullivan, C.; Clarke, G.; Shanahan, F.; Dinan, T. G. & Cryan, J. F. (2016). Adult microbiota deficient mice have distinct dendritic morphological changes: differential effects in the amygdala and hippocampus. Eur. J. Neurosci. 44(9):2654-2666.
(23) Hoban, A. E.; Stilling, R. M.; Ryan, F. J.; Shanahan, F.; Dinan, T. G.; Claesson, M. J.; Clarke, G. & Cryan, J. F. (2016). Regulation of prefrontal cortex myelination by the microbiota. Translational Pshychiatry. 6, e774.
(24) Rosas, H. D.; Doros, G.; Bhasin, S.; Thomas, B.; Gevorkian, S.; Malarick, K.; Matson, W. & Hersch, S. M. (2015). A systems-level "misunderstanding": the plasma metabolome in Huntington's disease. Ann Clin Transl Neurol.; 2(7):756-68.
(25) Kong, G.; Cao, K. L.; Judd, L. M.; Li, S.; Renoir, T. & Hannan, A. J. (2018). Microbiome profiling reveals gut dysbiosis in a transgenic mouse model of Huntington's disease. Neurobiol Dis. doi: 10.1016/j.nbd.2018.09.001
No hay comentarios.:
Publicar un comentario